肿瘤治疗已经步入“个体化精准治疗时代”。目前的精准治疗多为对同一癌种的不同亚型进行个体化治疗,即“同病异治”;进一步深究发病机制可知,不同的癌种间存在同种驱动基因,可就此给予相同的治疗方案,实现“同病同治”。基于分子生物标志物的治疗模式给患者生存带来极大改善,其核心源于精准诊断的发展。因此,随着NGS的普及,将有越来越多存在于不同肿瘤间的相同罕见靶点被发现,治疗方案将打破瘤种限制。
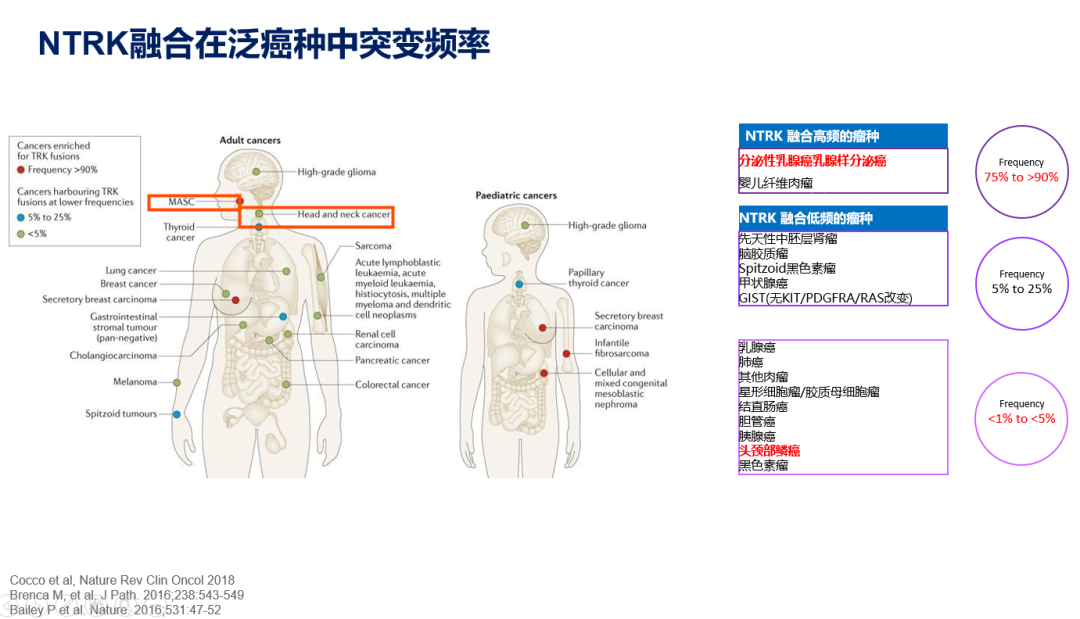
众多靶点中,NTRK在“同病同治”的发展中大放异彩。自1982年NTRK发现以来,人类先后在多种不同肿瘤中发现NTRK的身影,其中分泌性乳腺癌、婴儿纤维肉瘤为NTRK融合高频瘤种,突变频率为75%~>90%;脑胶质瘤、甲状腺癌等为低频瘤种,突变频率5%~25%;乳腺癌、肺癌、头颈部鳞癌等NTRK融合突变最为罕见,约为<1%~<5%。NTRK基因包含NTRK1、NTRK2、NTRK3三个亚型,分别参与表达TRKA、TRKB、TRKC三种结构类似、配体不同或交叉的跨膜蛋白,在与配体结合后,激活包括PI3K、MAPK等下游信号通路,影响细胞生长或增殖。
针对NTRK靶点的精准治疗,第一代TRK抑制剂恩曲替尼、拉罗替尼于2017年先后问世,二代TRK抑制剂Selitrctinb(Loxo 195)也获批用于TRK抑制剂耐药后使用,遗憾的是,目前我国暂未批准TRK抑制剂上市。作为FDA批准的首款可用于同时治疗NTRK和ROS1阳性的靶向药物,恩曲替尼有幸成为中国首个获批用于临床试验的TRK抑制剂,为国内患者带来一线希望。
临床前研究显示,恩曲替尼可在低纳摩尔浓度下有效抑制NTRK和ROS1,动物体内研究进一步证实伴NTRK或ROS1融合的肿瘤细胞系可在恩曲替尼作用下迅速消退,且该药临床前血脑比为0.4-2.2,可在中枢神经系统中大量暴露,效果持久高效。
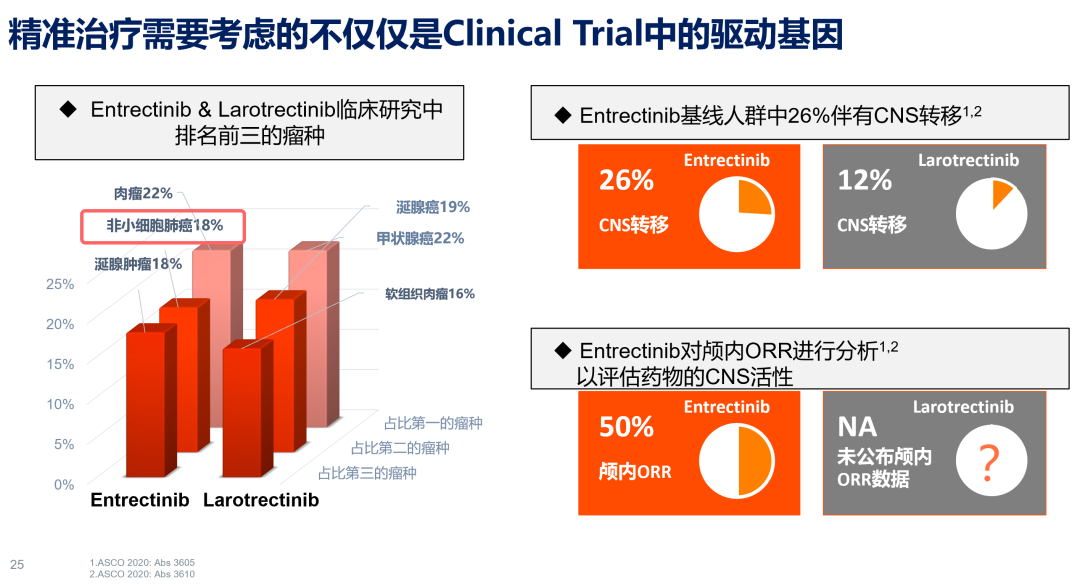
2020年ASCO公布了恩曲替尼I/II期临床研究的汇总分析结果,入选了ALKA-372-001、STARTRK-1、STARTRK-2三项临床研究。该研究评估了NTRK融合阳性、TRK抑制剂初治的成年实体瘤患者的疗效(n=74例)和所有接受恩曲替尼治疗人群的安全性(n=504例)。疗效评估人群中,有45%的患者接受了2线及以上治疗,约四分之一的患者伴随脑转移。结果显示,恩曲替尼治疗的NTRK融合阳性的实体瘤ORR可达63.5%,一线治疗ORR达80%、中位DoR暂未达到,二线三线治疗ORR亦可达到60%以上、中位DoR超过11个月,显示出对不同治疗线数患者均能持久有效。此外,存在脑转移患者的ORR达50%,中位颅内DoR 8.0个月,中位颅内PFS 8.9个月,具有不俗的颅内疾病控制效果。
2020年ESMO-Asia分析了该三项研究中恩曲替尼治疗NTRK融合阳性亚裔人群(n=11)的疗效,ORR达69.2%,中位DoR 10.4个月,中位PFS 14.9个月,颅内ORR 100%,与整体人群一致。

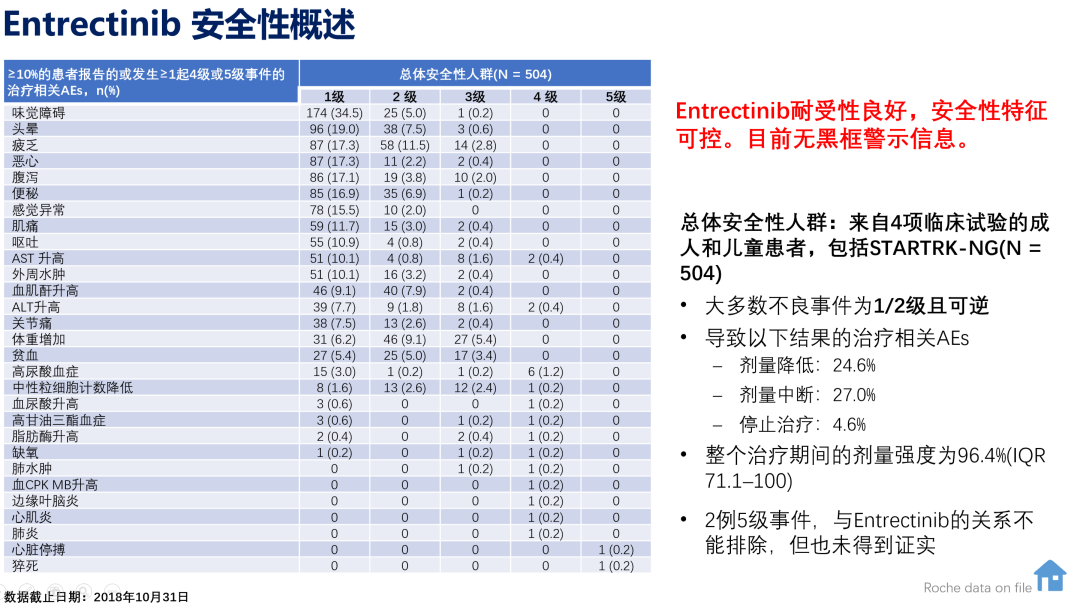
恩曲替尼耐受性良好,504例患者的安全性风险显示最常见的不良事件为味觉障碍、头晕、乏力,多为1-2级且可逆,目前无黑框警示信息。
另一个TRK抑制剂拉罗替尼Ⅰ/Ⅱ期临床研究综合分析数据显示(n=55),对于NTRK融合阳性的所有患者(含儿童)ORR为79%,mPFS为28.3个月,但遗憾的是,由于拉罗替尼通过P-gp转运蛋白主动转运出脑,未能得到其CNS活性的报告,其常见不良事件则为疲乏、ALT升高、咳嗽、便血,亦无药物相关5级事件。回顾基线人群,可发现恩曲替尼研究中入组排名前三的瘤种为肉瘤、NSCLC和涎腺肿瘤,多伴有脑转移;拉罗替尼研究则为甲状腺癌、涎腺肿瘤和软组织肉瘤,NTRK融合阳性率相对较高,脑转移患者较少。
因此,由于人群差异的存在,研究间的比较应审慎处理,总体而言,一代TRK抑制剂均有良好的疗效和安全性。
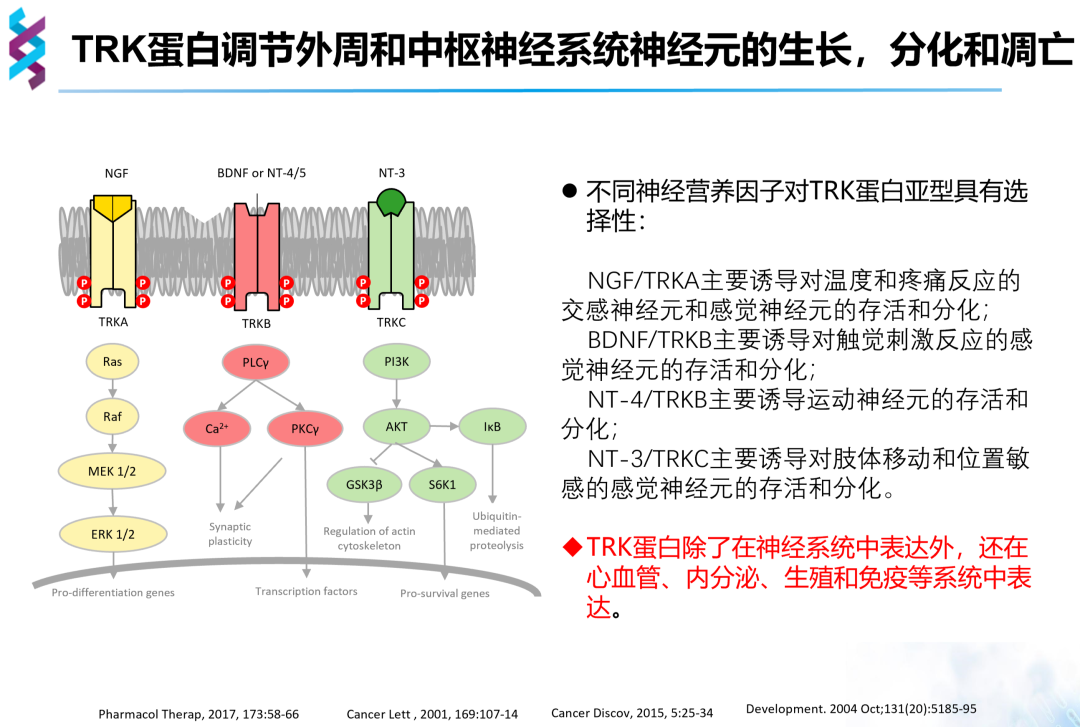
NTRK基因的三种亚型分别位于三种不同的染色体上,分别编码三种TRK蛋白。TRK蛋白是一种受体酪氨酸激酶,包含膜外受体结合区、跨膜区和细胞内激酶区,在与配体结合后发生二聚体化,使胞内酪氨酸激酶磷酸化并激活。不同的TRK蛋白具有不同的神经营养因子配体,激活不同的信号通路,其中TRKA主要激活Ras-MEK-ERK通路、TRKB主要激活PLC信号通路、TRKC主要激活PI3K-AKT信号通路,进而实现调节神经元的生长、分化和凋亡。
人类发现多种肿瘤中存在NTRK基因融合现象,进而形成融合蛋白,虽然其5’端融合伴侣多样,但酪氨酸激酶功能域持久存在,该区域的异常激活将引发细胞异常增殖、分化,造成癌变。NTRK融合在常见肿瘤中发生频率低,我国肺癌、乳腺癌NTRK融合频率仅为0.3%,在某些罕见肿瘤中极高,在婴儿纤维肉瘤NTRK融合频率可达90%以上,呈现出“大肿瘤、小突变,小肿瘤、大突变”的特点。
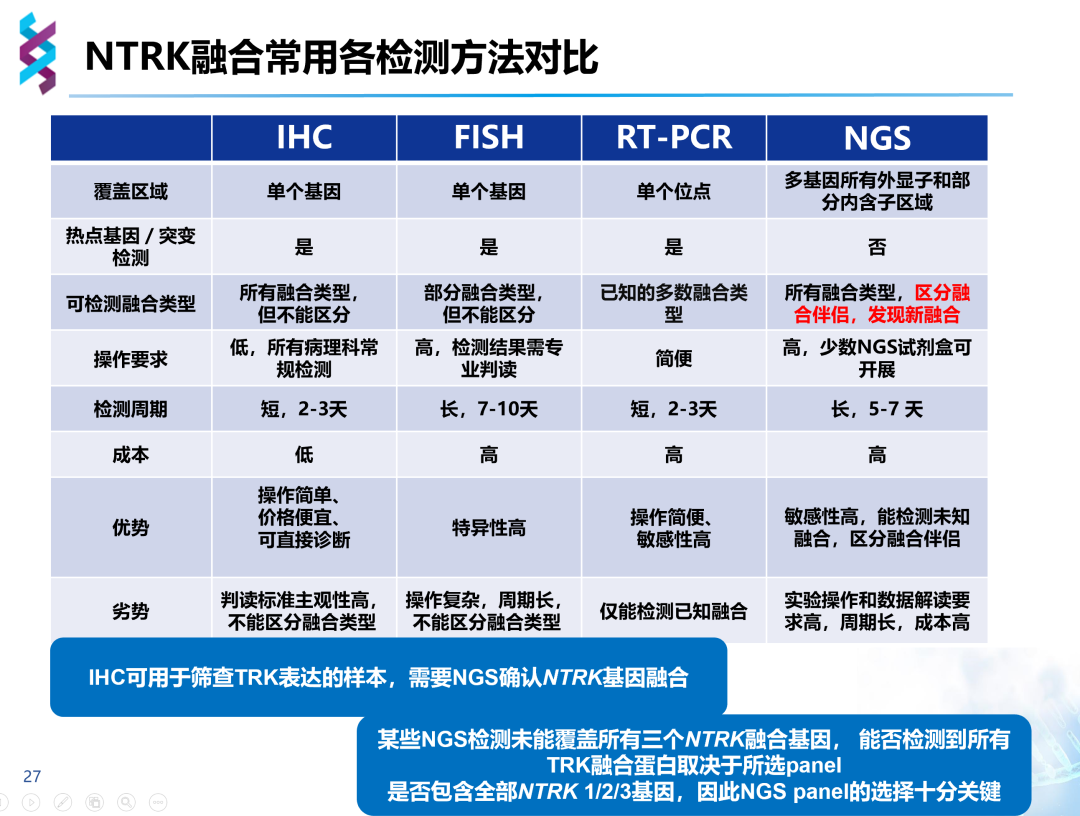
IHC、FISH、RT-PCR、NGS检测NTRK融合
NTRK基因融合特性更复杂,具有三种亚型分位与不同染色体、内含子区域大、GC序列丰富高、融合断点多样化等一系列特点,目前在超过20种了瘤种里发现了逾60种融合伴侣,给临床诊断带来了巨大挑战。NTRK检测主要有识别基因重排和检测融合蛋白表达两种途径,包括IHC、FISH、RT-PCR、NGS四种检测技术。
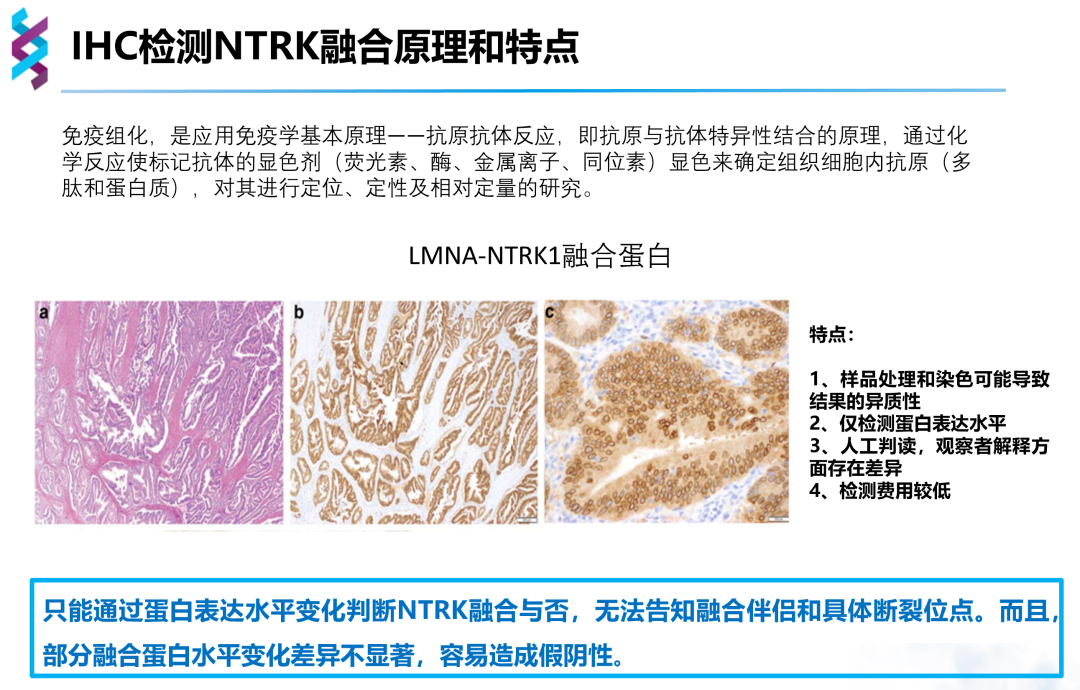
IHC基于抗原抗体反应原理,通过蛋白表达水平变化判断NTRK是否融合。IHC检测速度快,费用低,但仅能检测蛋白水平变化,无法明确融合伴侣及断裂位点,当NTRK融合阳性可正常表达TRK蛋白时,易造成假阴性结果,且该方法依赖于人工判读,对病理医生有较高的要求。目前Pan-TRK试剂盒已获批用于NTRK融合的初步筛选,但检测结果仍需NGS验证,以确定该过表达是否源于NTRK基因融合。
FISH基于切片组织通过杂交荧光技术、互补DNA或RNA检测染色体水平突变。较于IHC,FISH需要组织量小、更准确、更客观,同样周转较快。由于NTRK有三种亚型,每组融合探针只能检测一种融合方式,故全部检测需要三组不同探针,价格昂贵;同时,FISH只能提示NTRK是否融合,亦无法获得融合伴侣及融合方式,无法判断融合基因是否具有生物学功能,对分离距离较近的断裂融合难以识别,判读具有主观性,仍需要NGS进一步确认。

RT-PCR基于PCR检测,使用特定RNA序列识别肿瘤细胞RNA中已知的突变。其需要肿瘤细胞体积少,价格低,时效快,但该方法只能检测已知序列,很大程度上仅限于检测单个突变,检测结果依赖于RNA的质量,具有一定局限。

NGS检测在将NTRK融合基因碎片化后,通过探针将NTRK基因与融合基因富集,再进行测序并与人类基因组序列匹配,以获知NTRK基因与融合基因的断裂重排位置等具体信息。NGS需要的样本量少,通过直接测序获得信息、高度敏感,结果可靠,可在短时间内对多个基因进行平行测序,多重检测,通量高,一次覆盖NTRK所有亚型及常见和罕见靶点,结果全面而准确。

由此可见,较之IHC、FISH、RT-PCR,NGS覆盖所有融合基因,可以区分融合伴侣,发现新融合,因此,NGS已成为临床今后的检测方向。
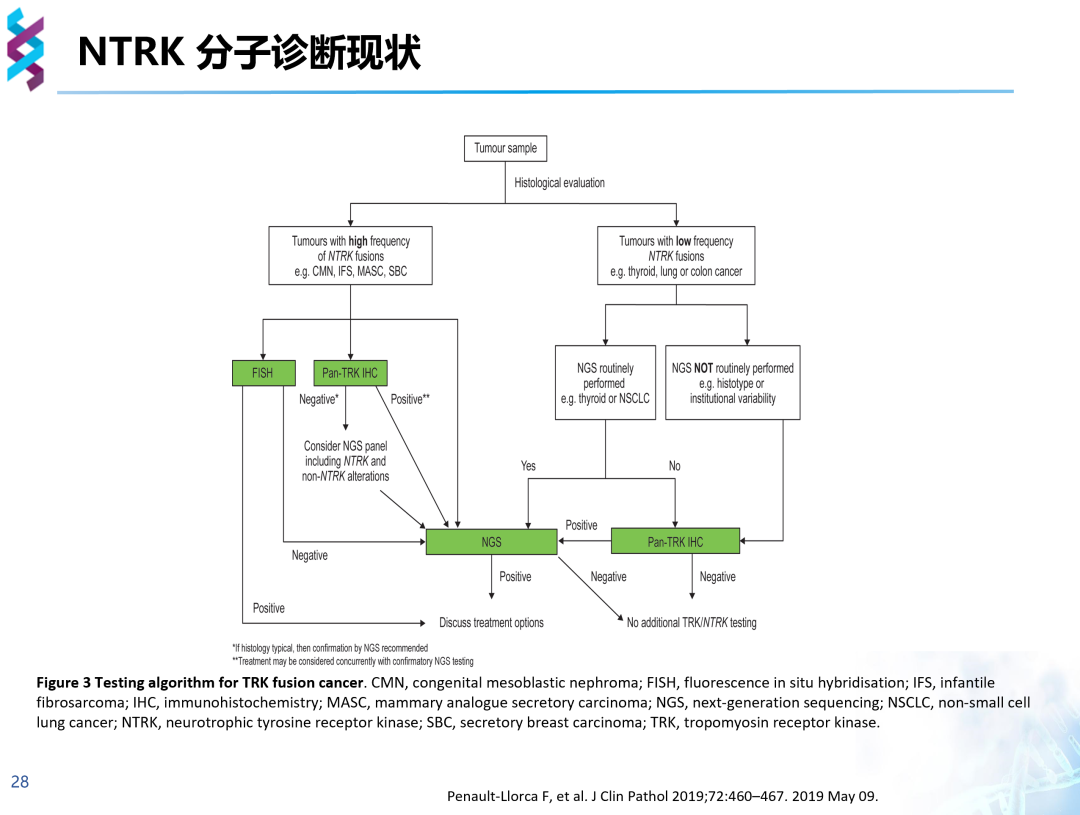
在对NTRK融合的临床诊断中,往往先通过形态学分析识别肿瘤样本判断是否为NTRK融合高频肿瘤,若为NTRK融合高频肿瘤,则可以选择FISH、Pan-TRK IHC进行初步判断后再行NGS检测,或直接行NGS检测;若为NTRK融合低频肿瘤,具备NGS平台则选择NGS检测,不具备NGS平台则在Pan-TRK IHC初步检测为阳性后选择其他NGS平台检测。
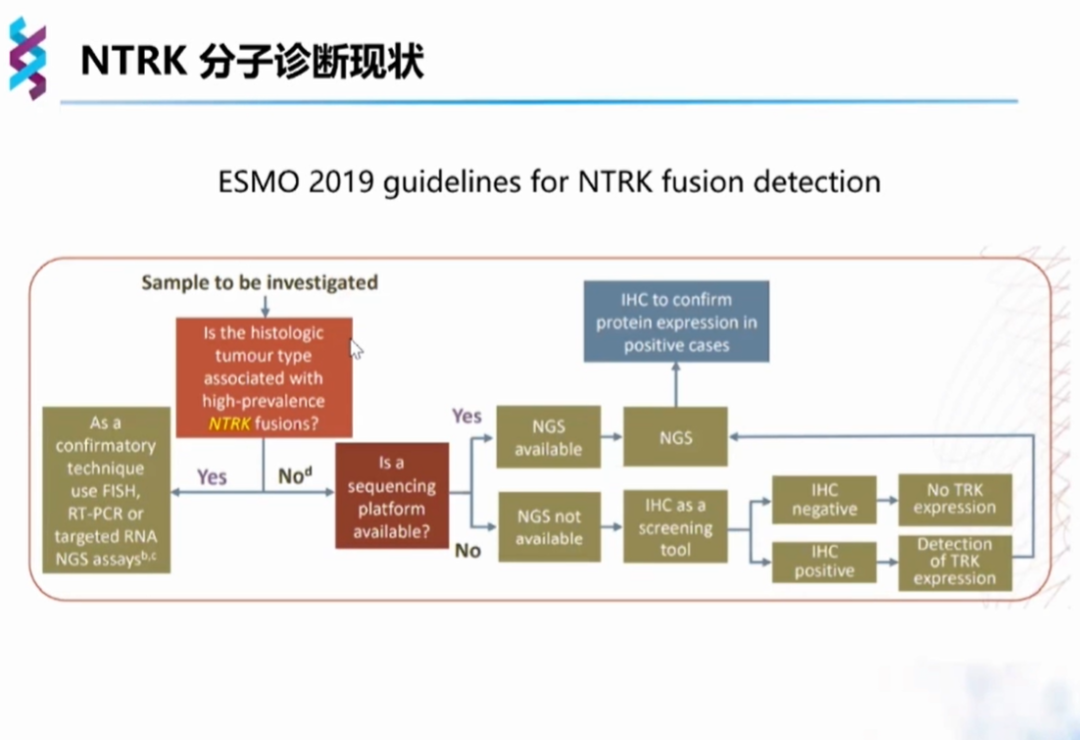
2019年ESMO指南也作了类似的策略推荐,在组织形态学分析后,NTRK融合高频肿瘤可选择FISH、RT-PCR和NGS检测;NTRK融合低频肿瘤优先选择NGS检测,在NGS不可及的情况下方考虑IHC等手段初筛。
近期,诸多大panel NGS检测新型NTRK基因融合的研究陆续发布,不断探求肿瘤亚型进展机制,分析NTRK融合图谱,探索NTRK阳性患者靶向治疗的进展,将对后续临床诊断、治疗给予了更多提示。在多种检测NTRK融合的方法中,NGS以其高通量、更精确的特性成为首选的检测方法,将进一步助力发现更多NTRK基因融合类型,提高患者临床获益。
陆舜教授:肿瘤标本可行DNA检测或RNA检测,对于NTRK融合基因检测应作何选取?
韩博教授:目前针对NTRK融合基因更倾向于RNA检测。也有观点认为结合DNA、RNA双重检测会较单纯的DNA或RNA检测更高效,其数据的准确性,NTRK阳性检出率更高。?
陆舜教授:NTRK融合基因检测多通过肿瘤组织样本检测,那么正在兴起的液体检测是否可用于NTRK检测?
韩博教授:对此尚欠缺足够的数据支持,个人对此方面经验不多。根据与兄弟单位交流与临床反馈,液体检测如胸水、腹水中RNA活性更佳,可以作为一种融合基因检测的方法,在ALK等基因中已有初步运用。但值得注意的是,临床中存在一些病例的液态检测生信分析的阳性检出率可能更低,是当下亟待解决的问题。
陆舜教授:肿瘤的原发灶和转移灶的NTRK融合基因是否会有差异?
韩博教授:从现有报道来看,肿瘤原发灶和转移灶的NTRK融合基因不同的情况是存在的。而从病理角度而言,原发灶或转移灶的NTRK突变可能在早期已经发生,二者间差异应该不多,因目前尚欠缺数据证实,尚需进一步探索。?
陆舜教授:NTRK基因的三种亚型是否会影响药物疗效?
李娟教授:这一点也是我在恩曲替尼和拉罗替尼数据公布时所关注的。众所周知,NTRK基因有三种亚型,也有更多的融合搭配,但目前研究数据并未对这些亚组进行分析,相信随着TRK抑制剂研究数据的逐步揭示,我们会很快看到其中的异同,非常令人期待。?
陆舜教授:TRK抑制剂在NTRK融合阳性患者的二线及以上治疗的疗效毋庸置疑,在一线使用是否优选TRK抑制剂?是否可以选择免疫治疗?
李娟教授:根据目前恩曲替尼和拉罗替尼的数据可基本确立TRK抑制剂一线治疗NTRK融合阳性患者的地位,在一线人群中,恩曲替尼取得了当前最高的ORR和DoR,而后线人群疗效则不如一线,故TRK抑制剂应早期使用、一线使用。而对NTRK靶点的免疫治疗目前仍欠缺数据,需要继续探索。
陆舜教授:现下我们正在开展STARTRK-2研究,为一项仅入组成人患者的篮子研究,而国外的研究设计时儿童与成人均予以纳入,对此类不限制瘤种的临床研究的设计与执行有怎样的建议?
李娟教授:个人浅见,在篮子研究设计时应对儿童、成人予以区分,虽然儿童和成人具有共有的驱动基因,但儿童肿瘤患者的用药剂量、给药方式与成人是不同的,所以区分入组应该更为合理。
陆舜教授:我十分认同您的观点,在对STARTRK-2研究设计时,虑及儿童患者对药物的耐受程度和安全性,在最终的患者入选标准中仅纳入18岁以上的成人患者。对于儿童患者的疗效和安全性的分析,还需更严密、更谨慎的对待。
Tip:实体瘤患者可就近选择以下单位参与临床研究,获得TRK抑制剂治疗





 京公网安备 11010502033352号
京公网安备 11010502033352号